- Москва, ул. Тестовская д.10
- info@cryobiobank.com

Это область исследований и клинических применений, ориентированных на восстановление и регенерацию клеток, тканей или органов с целью восстановления поврежденных функций. Новые методы в регенеративной медицине используют зрелые мезенхимальные клетки (стволовые клетки, содержащиеся в стромально-васкулярной фракции или SVF жировой ткани пациента для клеточной регенерации).
Человеческое тело состоит из различных типов клеток, и каждая из них выполняет определенную функцию, чтобы организм мог работать правильно. Клетки, которые дают начало всем этим типам клеток, являются стволовыми клетками.
Стволовые клетки могут делиться, дифференцироваться и восстанавливаться, производя больше стволовых клеток, не теряя своего потенциала и не уступая место другим типам клеток.
Чтобы объяснить все развитие стволовых клеток с момента их открытия до настоящего времени, это можно представить для большей легкости в форме списка с соответствующими годами и различными именами ученых, которые внесли свой вклад.
Каждое из этих открытий и достижений помогло исследователям в его понимании и в использовании клеток, поскольку важно знать предысторию работы, предшествующей данному исследуемому элементу.
Стволовые клетки могут делиться, дифференцироваться и восстанавливаться, производя больше стволовых клеток, не теряя своего потенциала и не уступая место другим типам клеток (Рис.1).
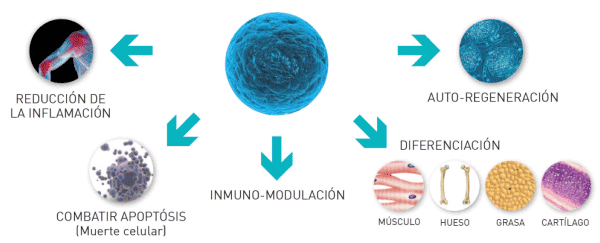
Рисунок 1: Стволовые Клетки
Они задействованы в процессе регенерации или восстановления поврежденных тканей и замещают клетки, погибающие по разным причинам (травмы, болезни, возраст и т. д.).
Материнская клетка — это недифференцированная клетка, обладающая способностью к обновлению и дающая начало клеткам, дифференцированным от одного или нескольких происхождений. Стволовые клетки классифицируют на основе их потенциальном росте. Стволовые клетки, которые могут дифференцироваться (трансформироваться) в линии / специфические клеточные линии (мышечные клетки, жировые ткани, хрящи, кости, сухожилия и т. д.) являются материнскими мезенхимальными клетками.
Мезенхимальные клетки идентифицировали и получили различное происхождение, например костный мозг путем пункции, BMSC (стволовые клетки костного мозга) или жировую ткань, называемую ADSC (стволовые клетки, полученные из жировой ткани). В центре внимания находятся АDSC, клетки, происходящие от жировой ткани, так как белая жировая ткань (обычно называемая «жиром») является наиболее распространенным источником мезенхимальных материнских клеток. Грубо говоря, это 1% жировых клеток человека к 0,0015% клеток костного мозга.
Количества и целесообразности использования стволовых клеток больше из жировой ткани, чем в костном мозге.
Форма извлечения более легкая, быстрая и менее травматичная в жировой ткани, чем в костном мозге. (Рис. 2).

Рисунок 2: жировая ткань
Таблица 1. смесь ядросодержащих клеток
|
25 to 45% |
гемопоэтические клетки. |
|
15 to 30% |
стромальные клетки / стволовые клетки. |
|
10 to 20 % |
эндотелиальные клетки |
|
5% |
перициты |
Стволовые мезенхимальные клетки, содержащиеся в получении SVF или «стромально-васкульрная фракция» жировой ткани, обладают теми же возможностями и клеточными маркерами, что и в костном мозге.
Клетка, обладающая способностью дифференцироваться в клетках тканей трех эмбриональных плоскостей (эктодерма, мезодерма и эндодерма), зародышевой линии и витализирующего мешка, а также экстраэмбриональной (плацента). Они способны создавать полноценный организм.
Клетки, способные дифференцироваться между тремя эмбриональными плоскостями (эктодермой, мезодермой и эндодермой), зародышевой линией и витализирующим мешком. Они не могут создать целостный организм.
Клетки, способные дифференцироваться между различными родословными и генерировать только клетки их же плоскости или линии мезодермы.
Например: SVF и ADSC (стволовые клетки, полученные из жировой ткани)
Использование стволовых клеток (SVF и ADSC), полученных из жира с помощью мини-липосакции, вне всяких сомнений используются в регенеративной медицине.
Характеристики SVF и ADSC
Стромально васкулярная фракция формируется различными клетками, в том числе стволовыми взрослыми клетками, обладающими способностью регенерировать те ткани, которые были повреждены не столько травмой, сколько собственным старением и клеточным износом. В SVF жировой ткани находят большое количество и целесообразность
Стволовых клеток с регенеративной способностью генерировать новую жировую ткань
Кровь также продуцирует факторы роста, которые помогают выжить адипоцитам и развития сосудистой сети [7].
После липосакции, выполненной вручную для выделения клеток SVF с помощью ферментативной реакции, промывки ферментативного остатка, центрифугирования, мы получаем отделенные адипоциты из гранулы (осадка) более плотного SVF. Гранула SVF содержит клетки, полученные из крови, стволовые клетки, полученные из жировой ткани, эндотелиальные клетки и другие клетки, которые находятся в жировой ткани. Они различаются у каждого из людей.
В соответствии с IFATS (International Federation of Adipose Therapeutics and Science) и ISCT International
Кроме того, доказано, что смесь SVF и аутологичных жиров способствует ангиогенезу при заживлении ран, способствует клеточной дифференцировке, улучшая тем самым васкуляризацию и выработку коллагена.
* Потенциал, который имеет SVF: 37% клеток без адипоцитов занимают эту часть.
Капли центрифуги — это клетки производной материнской жировой ткани (ADSC).
Они показали, что клетки производной материнской жировой ткани достигают дифференцировки in vitro в нескольких направлениях, между которыми обнаруживают адипоциты, хондроциты, гепатоциты и остеобласты, а также эндотелиальные, эпителиальные, кроветворные, нервные и миогенные клетки.
Большее число пациентов, обратившихся и / или сообщивших, были направлены на реконструктивные процедуры, включающие молочную железу (мягкие ткани) и восстановление свища (болезнь Крона) [8].
В случае реконструкции молочной железы аутологичные клетки SVF рекомбинируют с собственной тканевой липосакцией пациентки с концами трансплантата жира.1SVF, это имеет значительный клинический потенциал для лечения различных ортопедических патологий, как это было замечено в исследованиях на людях. Его применяют при лечении больных остеоартрозом (ОА), хондромаляцией, разрывом мениска, остеонекрозом головки бедренной кости и травмами сухожилий [9].
Регенерация хряща, обезболивание, заживление ран, лечение хронических заболеваний сердца, сахарного диабета, иммунорегуляция и др.
Пластическая хирургия и эстетическая медицина: увеличение и реконструкция груди, коррекция складок, омолаживание лица и тела и др.
Специальности: травматология, хирургия позвоночника, урология, гинекология и др.
Травматология: остеоартроз (ОА), хондромаляция, разрыв мениска, остеонекроз головки бедренной кости и травмы сухожилий, травмы дегенеративных дисков [10].
Через небольшую липосакцию (мини-липосакцию), обычно из брюшной зоны или внутренней части бедра, из-за легкости доступу. Процесс осуществляется под местной анестезией. Обычно этого достаточно образца 50 грамм жировой ткани, и пациент сможет сразу же вернуться к своей повседневной жизни.
Было доказано увеличение эффективности на 22% выше для клеток SVF, когда образец жира был получен из туловища, по сравнению с тем, когда он был получен из членов другой части тела.
После дезинфекции донорского участка йодом и подготовки операционного стола, вводят мепивакаин до 1% в кожу под пупком на глубину 3 мм с листком бистури № 11. Практикуется ручная тумесцентная липосакция с анестезирующей формулой Клейна модифицированной (500 мг лидокаина 5% + 12,5 meq H2CO3Na + 1 мг адреналина 1: 100.000 в 1 литре холодного лактата Рингера), с помощью трубок, просверленных в нескольких отверстиях диаметром 3 и 4 мм и отличающейся конструкцией, соединенных со шприцами 50 см3,с ручным механизмом для остановки. Механическое разрушение дольки жировой ткани в толще глубокого отсека нижней гемиабдомы позволяет достичь липосакции, то наполнять лабораторные пробирки размером 50 см3, заполняя только 20 см3 их емкости.
Независимая лаборатория оценила набор Smart X для получения SVF с помощью четырех образцов, которые показывают его клеточную численность, клеточную целесообразность, безопасность и эффективность по сравнению с ручной системой (лабораторная культура).
Набор системы используется для отделения жира, промывки фермента, извлечения SVF и стволовых клеток и фильтрации отходов производства.
Комплект SMARTX включает в себя единую технологию и одобрен международными патентами.
Клеточная численность более 700 000 ядросодержащих клеток достигается за счет 1cc. Клеточная целесообразность: 98,58% ядросодержащих клеток (живых клеток).
Это достигается с помощью короткого замыкания, которое гарантирует высокую конечную осуществимость ячеек. Количество и целесообразность производных стволовых клеток максимизируется через жировую ткань с минимумом
потери клеток. Основана на следующих концепциях: минимизация клеточного сдвига и термического эффекта (патент 1). Передвижение клеток вверх и вниз по клеткам осуществляется мягким способом без применения специфического давления (патент 2).
Это минимизирует загрязнение воздуха во время процесса.
Перенос набора в шприц осуществляется в закрытой системе, является одновременно безопасным и эффективным. Ферментативный остаток: 0 (после 3º процесса промывки не остается никакого ферментативного остатка).
Имеет оперативную стоимость и первоначальные более низкие инвестиции.
Чтобы произвести весь процесс, минимальные вложения требуются исключительно в: оборудование: инкубатор / Термо-мешалка + центрифуга + ламинарный расходометр (опционально).
Расходные материалы: одноразовый смарт-комплект.
Персонал с базовой подготовкой.
Включает в себя очень простой метод обработки, который облегчает работу врача. Человеческий ресурс: требуется квалифицированный персонал с базовой подготовкой.
Соответствует всем законодательным требованиям и европейским директивам по маркировке CE.
Регенеративная медицина включает в себя большое количество субспециализаций, каждая из которых имеет свое законодательство и законы, которые к ним применяются.
Наиболее широко распространенной в регенеративной медицине является трансляционная медицина, которая в эти моменты включает и использует 2 различных метода: извлечение факторов роста (плазмы, богатой тромбоцитами) из венозной крови пациента и их аутологичную имплантацию в один и тот же хирургический акт. Экстракт мезенхимальных стволовых клеток из ткани взрослого человека, в нашем случае из стромальной васкулярной фракции жира (SVF-Stromal Vascular Fraction), который может быть получен из: жировой ткани (с процентом ADSC – Adipose Derived Stem Cells), из костного мозга (с процентом BMSC – Bone Brain Stem Cells).
Для того чтобы методы, включающие экстракцию и инфильтрацию, обычно используемые, были в юрисдикции испанских и европейских правил, они должны выполняться с определенными требованиями, а именно: невозможность подвергать биологическую ткань тому, что известно как существенная манипуляция, и что это должным образом предусмотрено общеевропейским законодательством.
Придется осуществить его имплантацию в зоне, где также существует та же стромальная — васкулярная фракция (SVF).
Кроме того, он должен будет проводить процесс в одном и том же хирургическом виде, не имея возможности достать или переместить биологическую ткань из помещения экстракции, то есть всегда будет операционной.
Наконец, это техническая часть, которая может быть использована только в аутологичном виде, то есть извлекать ткани и отдает обратно тому же человеку.
Все это переносится в техническую сторону, используемому при назначенном лекарстве или прикладной терапии.
В настоящее время» предпочтительно » получать мезенхимальные стволовые клетки из брюшного жира пациента, что обусловлено их преимуществами, высокой жизнеспособностью клеток, существующих в этой донорской области, их легким доступом и небольшим количеством или отсутствием хирургических осложнений. Если терапия проводится таким образом, с соответствующими протоколами лучших клинических практик и в замкнутом контуре, сохраняя всегда и строго стерильность, все юридические последствия трансляционной медицины будут соблюдены, согласно королевскому указу 1301/2006, принятому 10 ноября, и его последующей замене, РД 9 / 2014, принятому 4 июля 2014 года.
Источник: www.oatext.com